ΔΙΕΘΝΗ ΕΡΕΥΝΗΤΙΚΑ ΝΕΑ
Κατά καιρούς θα παρουσιάζουμε ενδιαφέροντα ερευνητικά νέα από την διεθνή βιβλιογραφία, σχετικά με τον ραγδαία αναπτυσσόμενο τομέα της νευροανοσολογίας.
α. Τα αντι-MOG αντισώματα πιθανόν να εμφανίζονται συχνότερα από τα αντι-AQP4 στο φάσμα διαταραχών NMO
Την τελευταία διετία αποκτά αυξανόμενο ενδιαφέρον η ανίχνευση αντισωμάτων κατά της MOG (myelin oligodendrocyte glycoprotein) για τη διάγνωση του φάσματος ασθενειών της οπτικής νευρομυελίτιδας (neuromyelitis optica spectrum disorders, NMOsd). Τα αντι-MOG αντισώματα σε απομυελινωτικές νόσους ήταν γνωστά από πολλά έτη, αλλά προφανώς λόγω ατελειών στις μεθόδους ανίχνευσης, στερούντο ειδικότητας. Με την ανάπτυξη βελτιωμένων μεθόδων (με κυτταρικό ανοσοφθορισμό, CBA) δείχθηκε πρόσφατα από μερικές ερευνητικές ομάδες ότι τα αντι-ΜOG αντισώματα εμφανίζονται ειδικά σε αρκετούς (10-25%) ΝΜΟ ασθενείς, οροαρνητικούς σε AQP4. Πολύ ποιό ενδιαφέρουσα όμως είναι μια πολύ πρόσφατη δημοσίευση της ομάδος της Α. Vincent (Πανεπ. Οξφόρδης) σε συνεργασία με άλλες διεθνείς ομάδες (Waters et al. Neurol Neuroimmunol Neuroinflamm. 2015;2(3):e89. doi: 10.1212/NXI.0000000000000089). Αρχικά έδειξαν ότι κλειδί για την ανίχνευση αντι-MOG αντισωμάτων ειδικών για μη-MS απομυελινωτικές νόσους είναι ο αποκλεισμός των αντισωμάτων της IgM τάξης. Μελέτησαν ορούς από 1100 ασθενείς για τους οποίους είχε ζητηθεί διάγνωση αντι-AQP4 αντισωμάτων (δηλαδή ασθενείς με υποψία για NMOsd). Εντόπισαν πάνω από 65 ορούς θετικούς σε αντι-MOG αντισώματα της ΙgG1 υπόταξης, ενώ μόνο 40 ασθενείς είχαν αντι-AQP4 αντισώματα (και μόνο ένας ήταν διπλοθετικός). Δεν ανιχνεύθηκαν αντι-MOG αντισώματα της ΙgG1 υπόταξης σε ορούς υγιών ατόμων ούτε σε MS ασθενείς. Αντίθετα, μεταξύ 58 ασθενών με κλασσική NMO, 37 (64%) είχαν AQP4 αντισώματα και μόνο 8 (14%) είχαν MOG αντισώματα.
Η MOG-NMOsd εμφανίζεται σχεδόν εξίσου συχνά σε άνδρες και γυναίκες, φαίνεται ότι επικρατεί η οπτική νευρίτιδα αλλά εμφανίζεται και επιμήκης μυελίτιδα, με πιο συχνή συμμετοχή του μυελικού κώνου και των βασικών γαγγλίων. Συνήθως έχει σημαντικά καλύτερη πρόγνωση από την AQP4-NMOsd.
β. Η μέτρηση των επιπέδων Tau και p-Tau στο ΕΝΥ είναι ποιό σημαντική από τη μέτρηση των επιπέδων της 14-3-3 για τη διάγνωση της Creutzfeldt-Jacob disease.
Η ανίχνευση της πρωτεΐνης 14-3-3 στο ΕΝΥ θεωρήθηκε αρχικά ως πολύ ειδική και ευαίσθητη για τη διάγνωση της CJD. Ωστόσο αργότερα βρέθηκε ότι η 14-3-3 ελευθερώνεται στο ΕΝΥ και σε άλλες ασθένειες με εκτενή απώλεια νευρώνων. Στις σχετικές δημοσιεύσεις η ευαισθησία της 14-3-3 συνήθως κυμαίνεται μεταξύ 85% και 95%, αλλά η ειδικότητά της μεταξύ 40% και 100%.
Αν και η μέτρηση της 14-3-3 παραμένει να έχει σχετική αξία για τη διάγνωση της CJD, η μέτρηση των επιπέδων της Tau και της φωσφορυλιωμένης Tau (p-Tau) στο ΕΝΥ φαίνεται ότι προσφέρουν μεγαλύτερη ειδικότητα και ευαισθησία. Πρόσφατες μεγάλες μελέτες (Skillbäck et al., JAMA Neurol, 2014, 71:476-83; Forner et al. Neurol Clin Pract, 2015; και editorials: H. Wood, Nat Rev Neurol, 2014, 10:180, και Couthart & Ances, Neurol Clin Pract, 2015) επιβεβαίωσαν μερικές προηγούμενες μικρότερες μελέτες που είχαν δείξει την αξία των υψηλών τιμών Tau και του λόγου Tau/p-Tau στη διάγνωση της CJD. Η μέτρηση της p-Tau έχει ιδιαίτερη σημασία για την διαφοροποίηση από την Alzheimer διότι ενώ η ολική Tau αυξάνεται και στις δύο ασθένειες (αν και γενικώς αυξάνεται περισσότερο στην CJD), η p-Tau δεν αυξάνεται στην CJD.
Στη μεγαλύτερη από αυτές τις μελέτες, οι Skillbäck και συν. (JAMA Neurol, 2014, 71:476-83) μελέτησαν τα ΕΝΥ από 93 επιβεβαιωμένους στην αυτοψία CJD ασθενείς και ~10.000 μη CJD ασθενείς από τη Σουηδική βιοτράπεζα, και επιβεβαίωσαν προηγούμενες μικρότερες μελέτες ότι ο συνδυασμός υψηλής τιμής Tau (>1400 ng/L) και υψηλού λόγου Tau/p-Tau (>25) αποτελεί αξιόπιστη παράμετρο για τη διάγνωση της CJD. Συγκεκριμένα οι μετρήσεις τους έδειξαν 99% ειδικότητα and 79% ευαισθησία για CJD. Συντηρητικότερος λόγος Tau/p-Tau (>17 αντί για >25) είχε ελαφρώς μικρότερη ειδικότητα (97%) αλλά αρκετά μεγαλύτερη ευαισθησία (93,6%).
Συμπερασματικά, ο συνδυασμός των μετρήσεων των επιπέδων των τριών δεικτών (14-3-3, Tau και p-Tau) προσφέρει πολύ εγκυρότερη διάγνωση από αυτήν ενός μόνο δείκτη.
γ. Μερικά αυτοαντισώματα είναι λιγότερο ειδικά από άλλα
Είναι γνωστό ότι η ανίχνευση αυτοαντισωμάτων έναντι ενός αντιγόνου ενεχόμενου σε ένα αυτοάνοσο νόσημα, ακόμη και όταν τέτοια αντισώματα μπορούν να προκαλέσουν το νόσημα σε πειραματόζωα, δεν αποτελεί απόλυτη πιστοποίηση ύπαρξης της εν λόγω ασθένειας. Συνήθως χρειάζονται και συμπληρωματικοί παράγοντες για την εκδήλωση της ασθένειας. Γι αυτό η κάθε εξέταση πρέπει να γίνεται μόνο σε ασθενείς με υποψία για την εν λόγω ασθένεια και πρέπει να συνδυάζει ο γιατρός τα εργαστηριακά με τα κλινικά ευρήματα για την τελική διάγνωση. Οι Dahm και συν (Ann. Neurol, 2014, 76:82-94) μελέτησαν ορούς από 1703 υγιείς και 2533 ασθενείς με νευροψυχιατρικές νόσους για την ύπαρξη αυτοαντισωμάτων έναντι 24 αντιγόνων του εγκεφάλου. Μάλιστα μελέτησαν ξεχωριστά τις τάξεις IgG, IgM και IgA των αυτοαντισωμάτων.
Βρήκαν εντυπωσιακά υψηλά ποσοστά ορών με αντι-NMDAR1 αντισώματα σε υγιείς μάρτυρες (~8,5% των υγιών) και αρκετά μικρότερα αλλά σημαντικά ποσοστά για αντισώματα έναντι amphiphysin (2.2%), ARHGAP26 (1.4%), CASPR2 (0.7%), MOG (0.5%), GAD65 (0.5%), Ma2 (0.5%), Yo (0.6%), και Ma1 (0.5%). Τα ποσοστά θετικών ορών υγειών για αντισώματα έναντι άλλων αντιγόνων (anti-AMPAR-1/2, AQP4, CV2, Tr/DNER, DPPX-IF1, GABAR-B1/B2, GAD67, GLRA1b, GRM1, GRM5, Hu, LGl1, recoverin, Ri, ZIC4) ήταν χαμηλά (≤0.1%) αλλά υπαρκτά. Αποκλεισμός των IgM αντισωμάτων και επικέντρωση στην ανίχνευση IgG αντισωμάτων βελτίωσε δραματικά την εικόνα για τα αντι-NMDAR1 αντισώματα (από 8,5% σε ~1.2% των υγιών), και σημαντικά μερικών άλλων αυτοαντισωμάτων, αλλά και πάλι το πρόβλημα υπάρχει. Συμπερασματικά, ψευδώς θετική ανοσολογική διάγνωση δεν μπορεί να αποκλειστεί, αλλά η επικέντρωση στην ανίχνευση IgG αντισωμάτων συχνά βελτιώνει σημαντικά τη διάγνωση. Επίσης, ψευδώς θετικά αποτελέσματα μειώνονται πολύ με τον έλεγχο του ΕΝΥ, ιδιαίτερα στην περίπτωση των αντι-NMDAR1 αντισωμάτων. Επειδή η συλλογή του ΕΝΥ δεν είναι εύκολη, μπορεί να συνιστάται μόνο σε περίπτωση θετικού ορού, αν ο κλινικός χρειάζεται περαιτέρω επιβεβαίωση για την τελική διάγνωση (κυρίως για NMDAR αντισώματα).
ΕΡΕΥΝΗΤΙΚΑ ΝΕΑ ΤΗΣ ΤΖΑΡΤΟΣ ΝΕΥΡΟΔΙΑΓΝΩΣΤΙΚΗ (2017-2022)
Η ερευνητική ομάδα της «Τζάρτος Νευροδιαγνωστική», σε συνεργασία με ακαδημαϊκά/ερευνητικά εργαστήρια και νευρολογικές κλινικές από την Ελλάδα (όπως του Ελληνικού Ινστιτούτου Παστέρ και του Τμήματος Φαρμακευτικής του Πανεπιστημίου Πατρών) και το εξωτερικό, συνεχίζει να παρουσιάζει αξιόλογο πρωτότυπο ερευνητικό έργο, στην μελέτη των αυτοάνοσων νευρολογικών ασθενειών. Ακολούθως παρουσιάζονται μερικές πρωτότυπες δημοσιεύσεις μας για τα διαστήματα 2019-2022.
Α. 2017- 9/2018
α. Ανάπτυξη νέων πολύ ευαίσθητων τεχνικών για τη διάγνωση της «οροαρνητικής μυασθένειας» (υπερευαίσθητες RIA για αντι-τιτίνη, αντι-AChR και αντι-MuSK αντισώματα, κυτταρικούς ανοσοπροσδιορισμούς για αντι-LRP4, αντι-MuSK και αντι-AChR αντισώματα, κ.α.).
β. Βελτιώσεις των τεχνικών διάγνωσης της οπτικής νευρομυελίτιδας (ΝΜΟ) για αντισώματα κατά AQP1, AQP4 και MOG, και μελέτη του ρόλου των αντι-MOG και αντι-AQP1 αντισωμάτων στην ασθένεια.
γ. Αναζήτηση νέων αυτοαντισωμάτων και αυτοαντιγόνων με πιθανή εμπλοκή τους σε νευρολογικές νόσους όπως αυτοάνοση εγκεφαλίτιδα.
Επίσης συμμετέχουμε και σε ερευνητικές εργασίες και χρηματοδοτήσεις εκτός της Τζάρτος ΝευροΔιαγνωστική: όπως την μελέτη μηχανισμών πρόκλησης αυτοάνοσων νευρολογικών ασθενειών (όπως μυασθένειας, NMO και σκλήρυνσης κατά πλάκας), την θεραπεία της μυασθένειας, την δομή του AChR κ.α. με αξιόλογες δημοσιεύσεις (π.χ. για την κρυσταλλική δομή του ανθρώπινου AChR: Zouridakis et al., Nature Struct & Mol. Biol. 2014 και Kouvatsos et al. PNAS, 2016, και ανασκοπήσεις για τη μυασθένεια: Gilhus et al., Nature Reviews Neurology, 2016 και υπό έκδοση στο Nature Reviews Disease Primers, 2018).
Μερικές πρόσφατες ερευνητικές εργασίες και ευρήματα της Τζάρτος ΝευροΔιαγνωστική (σε συνεργασία με ερευνητικούς και ακαδημαϊκούς φορείς) που αφορούν εξελίξεις στη διάγνωση αυτοάνοσων νευρολογικών νόσων συμπεριλαμβάνουν:
α. Αντι-τιτίνη αντισώματα σε "οροαρνητική" μυασθένεια - νέος ρόλος για ένα παλιό αντιγόνο (Hong et al. Eur. J Neurol. 2017 24:844-850; Cordts et al. J Neurol. 2017. 264:1193-1203)
Τα αντι-τιτίνη αντισώματα ανιχνεύονται με ELISA και αποτελούν δείκτη παρουσίας θυμώματος σε μυασθενείς ηλικίας <50 ετών, αλλά δεν συμβάλουν στη διάγνωση της μυασθένειας καθώς μέχρι πρόσφατα ανιχνεύονταν μόνο σε θετικούς σε αντι-AChR αντισώματα. Έχουμε αναπτύξει μια πολύ ευαίσθητη RIA για αντι-τιτίνη αντισώματα με την οποία πολλοί προηγουμένως τιτίνη-αρνητικοί οροί μυασθενών βρέθηκαν θετικοί, συμπεριλαμβανομένων αρκετών «τριπλά-οροαρνητικών» ασθενών. Αρχικά με αυτήν την RIΑ μελετήσαμε MG ορούς από 13 χώρες και βρήκαμε ότι το 13% (50/372) των τριπλά-οροαρνητικών μυασθενών είχαν αντι-τιτίνη αντισώματα. Κανένας από τους 121 υγιείς μάρτυρες ή τους 90 ασθενείς με μυοπάθεια δεν είχε αντι-τιτίνη αντισώματα, ενώ μόνο το 3,6% (7/193) των ασθενών με άλλες νευρολογικές νόσους είχε τέτοια αντισώματα (Stergiou et al. J. Neuroimm, 2016. 292:108-115). Ως εκ τούτου, προτείναμε ότι η RIA για αντι-τιτίνη αντισώματα είναι ένα χρήσιμο εργαλείο για τη διάγνωση της μυασθένειας στους τριπλά-οροαρνητικούς ασθενείς.
Ποιο πρόσφατα εφαρμόσαμε αυτήν την τεχνική και σε δύο ακόμη μελέτες μας με οροαρνητικούς ασθενείς από Κίνα και Γερμανία και βρήκαμε 6% και 27% των AChR/MuSK οροαρνητικών ασθενών Κίνας (Hong et al.) και Γερμανίας (Cordts et al.), αντίστοιχα, είχαν αντι-τιτίνη αντισώματα. Επίσης εφαρμόζουμε την νέα μέθοδο ερευνητικά και για τους αντι-AChR οροαρνητικούς ασθενείς που μας ζητούν τον κλασσικό έλεγχο για αντι-τιτίνη αντισώματα και στις θετικές περιπτώσεις ενημερώνουμε τους θεράποντες ιατρούς.
β. Νέες πολύ ευαίσθητες RIA για αντι-AChR και αντι-MuSK αντισώματα (Hong et al. Eur. J Neurol. 2017 24:844-850)
Έχουμε πρόσφατα αναπτύξει υπερευαίσθητες RIA για αντι-AChR και αντι-MuSK αντισώματα οι οποίες ανιχνεύουν ~5-10 φορές χαμηλότερες συγκεντρώσεις των αντίστοιχων αντισωμάτων. Στις RIA αυτές υπερδεκαπλασιάζουμε την αναλογία της ποσότητας του υπό έλεγχο ορού προς το ραδιενεργό αντιγόνο με αποτέλεσμα τον αντίστοιχο πολλαπλασιασμό του σήματος. Το κύριο πλεονέκτημα αυτής της τεχνικής είναι ότι διευκρινίζει την παρουσία ή απουσία των αντισωμάτων στην περίπτωση αμφίβολου αποτελέσματος με την κλασική RIA. Πρέπει πάντως να τονιστεί ότι πρόκειται για επιβεβαίωση της παρουσίας των ειδικών αντισωμάτων και όχι επιβεβαίωση της μυασθένειας. Εφαρμόσαμε ήδη την τεχνική αυτή στη μελέτη Κινέζων οροαρνητικών μυασθενών (σε συνεργασία με δύο διεθνείς κλινικές) και ανιχνεύσαμε χαμηλούς τίτλους αντι-AChR αντισωμάτων στο 25% των «οροαρνητικών» μυασθενών.
Ήδη εφαρμόζουμε τις υπερευαίσθητες RIA και σε όλους τους ορούς ασθενών που μας έλεγχο αντι-AChR και αντι-MuSK αντισωμάτων, χωρίς επιπλέον χρέωση, και όποτε υπάρχει διαφωνία μεταξύ των δύο RIA, ή σε αμφίβολο αποτέλεσμα με την κλασική RIA, δίνουμε και το αποτέλεσμα της νέας RIA ως παρατήρηση.
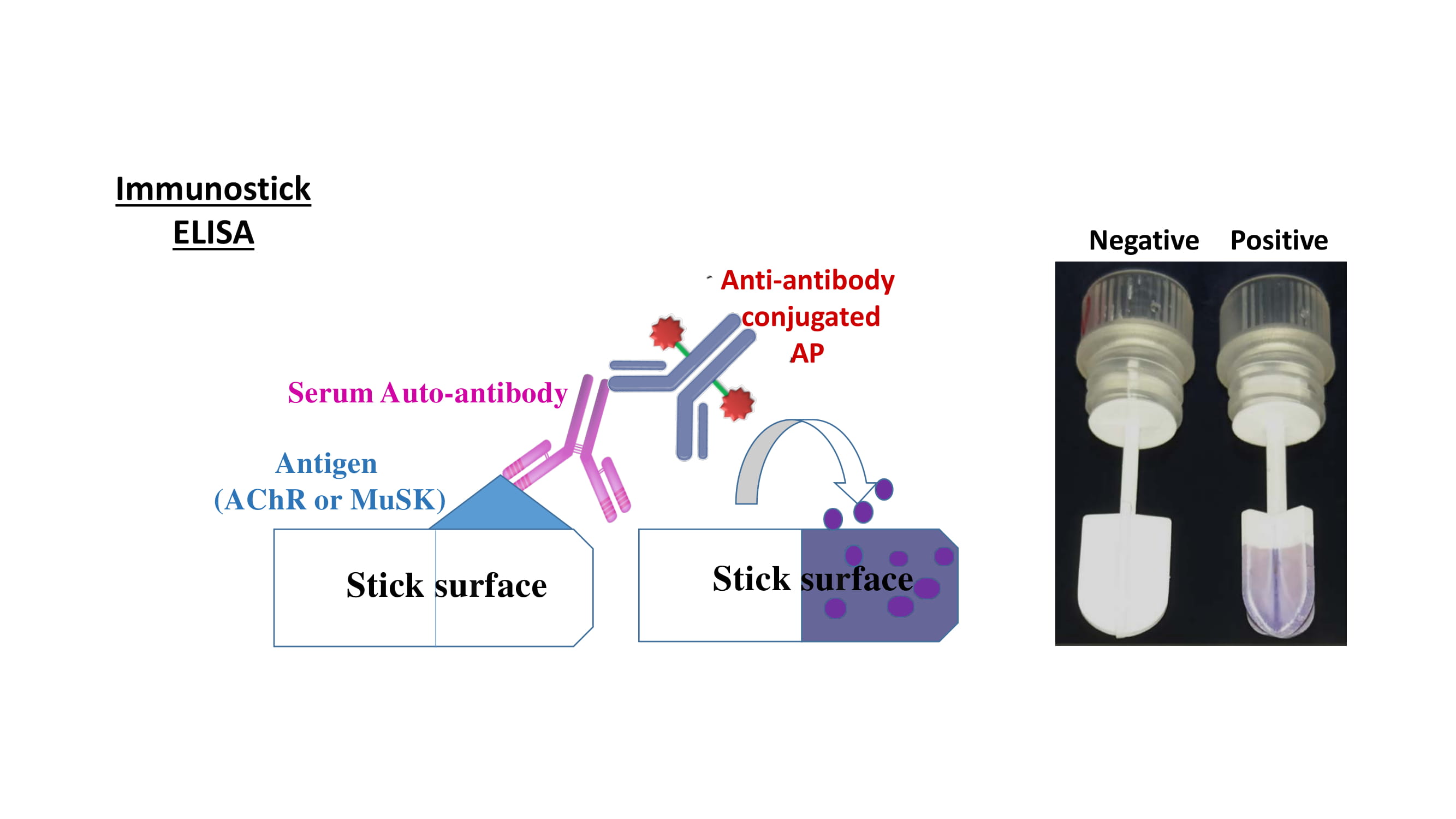
γ. Ανάπτυξη πολύ εύκολης και ταχείας μεθόδου ανίχνευσης αντι-AChR και αντι-MuSK αντισωμάτων στην κλινική/ιατρείο για την άμεση διάγνωση της μυασθένειας (Trakas N & Tzartos S. J Immunol Methods. 2018. 460:107-112)
Αναπτύξαμε πρόσφατα μια ταχεία και πολύ απλή μέθοδο για την άμεση ανίχνευση αντι-AChR και αντι-MuSK αντισωμάτων εκτός εργαστηρίου, όπως στο ιατρείο και στην κλινική. Είναι μια πολύ απλή ELISA η οποία δεν χρειάζεται εργαστηριακά όργανα και μπορεί να πραγματοποιηθεί σε <1 ώρα, σε μη εξειδικευμένο χώρο εξέτασης από μη ειδικευμένο προσωπικό. Βασίζεται στη χρήση ραβδίων (immunostick) επικαλυμμένων με τα κύρια αυτοαντιγόνα της μυασθένειας, υποδοχέα ακετυλοχολίνης (AChR) και/η MuSK. Ένα ραβδίο βυθίζεται σε ~0,5 ml ορού ή αίματος του ασθενούς, ακολουθούν πλύσεις του ραβδίου με νερό, και επώαση με δύο διαδοχικά διαλύματα. Στην περίπτωση παρουσίας των ειδικών αντισωμάτων το ραβδίο αποκτά χρώμα το οποίο αξιολογείται με το μάτι. Η μέθοδος αυτή αποδείχθηκε αξιόπιστη για την ανίχνευση αντι-AChR και αντι-MuSK αυτοαντισωμάτων. Σε σύγκριση με τα αποτελέσματα που προέκυψαν από τις κλασσικές RIA, η ειδικότητά της για αντι-AChR αντισώματα ήταν 99% (102/103 αρνητικοί οροί) και η ευαισθησία της ήταν ~94%. Πειράματα μικρότερης κλίμακας έδειξαν οτι η μέθοδος είναι το ίδιο αποτελεσματική και για τα αντι-MuSK αντισώματα.
Είμαστε τώρα σε συνεννόηση με εξειδικευμένη εταιρεία του εξωτερικού για την ανάπτυξη του κατάλληλου διαγνωστικού κιτ για ευρεία χρήση από κλινικές, θεράποντες ιατρούς και μικρά διαγνωστικά εργαστήρια.
 δ. AQP1 αντισώματα στην οπτική νευρομυελίτιδα (ΝΜΟ)
δ. AQP1 αντισώματα στην οπτική νευρομυελίτιδα (ΝΜΟ)Είναι ενδιαφέρον ότι πρόσφατα η ομάδα του E. Tuzun, σε συνεργασία με εμάς, βρήκαμε πρόσφατα ότι σε απομυελινωτική πλάκα ασθενούς NMO με αντι-AQP1 αντισώματα είχε εξαφανιστεί η AQP1 ενώ δεν είχε επηρεαστεί η AQP4 (Türkoğlu et al. Clin Neuropathol. 2017 doi: 10.5414/NP3010052017). Αυτή η παρατήρηση αποτελεί την πρώτη ένδειξη ότι τα AQP1 αντισώματα μπορούν να συμβάλλουν στην παθογένεια της ΝΜΟ.
Στη Τζάρτος ΝευροΔιαγνωστική ελέγχουμε πλέον όλους τους ορούς ασθενών που έρχονται στο εργαστήριό μας για διάγνωση NMO. Μόνο την τελευταία διετία έχουμε εντοπίσει 33 νέους ασθενείς με αντι-AQP1 αντισώματα και θα προχωρήσουμε, σε ερευνητική συνεργασία με όσους θεράποντες ιατρούς το επιθυμούν, στη μελέτη αυτών των περιστατικών για να καταλάβουμε τα ιδιαίτερα χαρακτηριστικά της AQP1-ΝΜΟ.
Η κεφαλαλγία και οι οπτικές διαταραχές είναι τα κύρια συμπτώματα της ιδιοπαθούς ενδοκρανιακής υπέρτασης (ΙΕΥ) που χαρακτηρίζεται από αυξημένη ενδοκρανιακή πίεση με άγνωστα αίτια. Διερωτηθήκαμε αν οι ασθενείς αυτοί έχουν αντισώματα κατά αντιγόνων της NMO (AQP4 και MOG) ή και μη χαρακτηρισμένων αντιγόνων της νευρωνικής μεμβράνης. Εξετάστηκαν οροί 34 ασθενών με ΙΕΥ και 40 υγειών, αλλά κανένας δεν εμφάνισε αντι-AQP4 ή αντι-MOG αντισώματα. Ωστόσο, οι οροί πέντε ασθενών με ΙΕΥ έδειξαν αντιδραστικότητα έναντι αντιγόνων μεμβράνης ιππόκαμπου αρουραίου και νευρώνων του φλοιού με ανοσοκυτταροχημεία. Είναι ενδιαφέρον ότι στη μαγνητική τομογραφία οι τρεις από τους πέντε ασθενείς είχαν μη ειδικές αλλοιώσεις στη λευκή ουσία, ενώ μόνο τέσσερις από τους υπόλοιπους 29 ασθενείς είχαν αυτές τις βλάβες (p = 0,048). Η συσχέτιση των ευρημάτων ανοσοκυτταροχημείας με την παρουσία αλλοιώσεων λευκής ουσίας μπορεί να υποδηλώνει ότι ανοσολογικοί παράγοντες συμβάλλουν στην παθογένεση της ΙΕΥ σε τουλάχιστον μερικούς από αυτούς τους ασθενείς.
Στο παρελθόν δείξαμε ότι τα αντι-LRP4 αντισώματα απαντούν, επιπλέον από την μυασθένεια, και σε σημαντικό ποσοστό των ALS ασθενών (J. Tzartos et al. Ann. Clin Transl Neurol. 2013. doi: 10.1002/acn3.26). H παρατήρηση αυτή επιβεβαιώθηκε και από τουλάχιστον δύο ακόμη ερευνητικές ομάδες, αλλά είναι ακόμη άγνωστο αν αυτά τα αντισώματα παίζουν κάποιο παθογόνο ρόλο στην ALS. Είναι ενδιαφέρον ότι πρόσφατα δείξαμε ότι τα αντι-LRP4 αντισώματα των ALS ασθενών προσδένονται ειδικά σε νευρώνες και προσελκύουν παράγοντες του συμπληρώματος (Tuzun et al.). Τα αποτελέσματα αυτά υποδηλώνουν ότι τα αντι-LRP4 αντισώματα των ALS ασθενών θα μπορούσαν να ενεργοποιήσουν το σύστημα του συμπληρώματος μετά τη δέσμευση τους στους νευρώνες και ενδεχόμενα να συμβάλουν στην παθογένεια της νόσου.
Οι ακουαπορίνες (AQP) απαντούν, επιπλέον από τα αστροκύτταρα, και σε αρκετούς άλλους ιστούς. Αρκετές AQPs (όπως οι 1, 5 και 8) απαντούν στους σιελογόνους αδένες και πιστεύεται ότι συμβάλλουν στις εκκρίσεις που σχηματίζουν το σάλιο. Η δυσλειτουργία των AQPs στους σιελογόνους αδένες μπορεί να συμβάλει στη δυσλειτουργία αυτών των αδένων στο σύνδρομο Sjögren (SS). SS και NMO φαίνεται να συνυπάρχουν σε ένα κοινό αυτοάνοσο περιβάλλον, ωστόσο αντι-AQP1 και αντι-AQP4 αντισώματα έχουν ανιχνευθεί μόνο στην NMO. Χρησιμοποιώντας 3 διαφορετικούς προσδιορισμούς (ELISA με συνθετικά πεπτίδια, RIA με ακέραιες AQPs και ανάλυση στυπώματος Western) αναζητήσαμε αντισώματα κατά των AQPs 1,3,4,5,8 και 9 στους ορούς 34 ασθενών SS χωρίς νευρολογικά ευρήματα. Βρέθηκαν συνολικά 13 (38,2%) ασθενείς με αντισώματα κατά των εξωκυτταρικών περιοχών της AQP1 (δύο ασθενείς), AQP3 (ένας ασθενής), AQP8 (έξι ασθενείς) ή AQP9 (τέσσερις ασθενείς). Αντίθετα, κανένας από τους 106 υγιείς μάρτυρες ή 68 ασθενείς με άλλες αυτοάνοσες ασθένειες δεν είχε αντι-AQP αντισώματα. Ασθενείς με αντι-AQP αντισώματα είχαν σημαντικά πιο σοβαρή ξηροφθαλμία από τους οροαρνητικούς, που υποδηλώνει έναν πιθανό παθογόνο ρόλο αυτών των αντισωμάτων σε ασθενείς με SS.
Β. 2019-2022
-
Ανάπτυξη νέας θεραπευτικής μεθόδου στην αντιμετώπιση των συμπτωμάτων της MuSK MG (οροθετική σε MuSK αντισώματα βαριά μυασθένεια) (γ)
-
Εξακρίβωση έγκυρου διαγνωστικού ελέγχου για τον έλεγχο της παρουσίας αντισωμάτων κατά της MOG πρωτεΐνης (ασθένεια MOG, απομυελινωτικά νοσήματα ΚΝΣ) (δ)
-
Διερεύνηση του ρόλου των αυτοαντισωμάτων έναντι της πρωτεΐνης GFAP, στην ασθένεια της ιδιοπαθούς ενδοκρανιακής υπέρτασης, στην αστροκυτταροπάθεια, και στην επιληψία. (ε,ζ,η)
-
Ανάπτυξη μεθόδου για την ειδική ανίχνευση πιθανά παθογενικών α3-nAChR αντισωμάτων στην ασθένεια της αυτοάνοσης αυτόνομης γαγγλιονοπάθειας. (θ)
-
Καθιέρωση της ειδικής μεθόδου RT-QuIC για την ανίχνευση της παθολογικής πρωτεΐνης prion (PrPSc) στο εγκεφαλονωτιαίο υγρό, στην νόσο Creutzfeldt-Jacob (CJD) (ι)
-
Αξιοποίηση της μέτρησης του βιοδείκτη pTau181 στο πλάσμα αίματος, για την διάκριση ασθενών με Alzheimer από άλλες νευρολογικές ασθένειες. (κ)
- Δεν παρατηρήθηκαν χαρακτηριστικές αλλαγές στην παθολογία του θύμου αδένα σε LRP4-MG ασθενείς
- Δεν μπορεί να αποκλειστεί ο ρόλος του θύμου αδένα στην παθογένεση της LRP4-MG, καθώς σε έναν ασθενή από τους LRP4-MG, παρουσιάστηκε κλινική ύφεση έπειτα από θυμεκτομή. Επίσης, η θυμεκτομή σε συνδυασμό με ανοσοκατασταλτική θεραπεία βελτίωσε την κλινική εικόνα ενός ακόμη LRP4-MG ασθενούς.
Τέλος, στην τρίτη δημοσίευση που αφορά την επιληψία σε παιδιά, μελετήσαμε την παρουσία αντί-GFAP αντισωμάτων σε 38 παιδιά με επιληπτικές κρίσεις μη εξακριβωμένης αιτίας. Η παρουσία GFAP αντισωμάτων ελέγχθηκε με κυτταρικό ανοσοπροσδιορισμό (CBA: cell based assay) και έμμεσα με ανοσοϊστοχημεία, και παρατηρήθηκε σε 2 αγόρια από τα 38, με φυσιολογικό MRI εγκεφάλου, και με ιατρικό ιστορικό που δεν υποδείκνυε αυτοάνοση νόσο, πριν την εκδήλωση επιληψίας. Συμπεραίνεται, ότι σε ασθενείς με επιληψία, η αυτοάνοση αστροκυτταροπάθεια μπορεί να υπάρχει σε ένα κλάσμα των ασθενών, ενώ το ερώτημα αν η αστροκυτταροπάθεια μπορεί να αποτελεί δευτερογενές προϊόν της νόσου της επιληψίας, ή αν αποτελεί παράγοντα άμεσης επιρροής στην νόσο, χρειάζεται να μελετηθεί περαιτέρω.
-
Σημείωση: Ήδη προσφέρουμε στην «Τζάρτος Νευροδιαγνωστική» αυτήν την μέθοδο για την διάγνωση της παρουσίας αντι-α3 αντισωμάτων, η οποία είναι επίσης οικονομικότερη και ταχύτερη.
- Η διαγνωστική αξία του pTau181 στο πλάσμα αίματος προσεγγίζει αυτήν της μέτρησης στο ΕΝΥ
- Η μέτρηση της τιμής AUC= 0,83, προσεγγίζει τις τιμές μέτρησης σε προηγούμενες παρόμοιες μελέτες
- Η ειδικότητα της μέτρησης ήταν χαμηλότερη του εύρους 80-85% και επομένως περαιτέρω βελτιώσεις είναι επιθυμητές
- Η ταυτόχρονη εκτίμηση και άλλων βιοδεικτών του πλάσματος, μπορεί να βελτιώσει περαιτέρω την διαγνωστική αξία της μέτρησης pTau181 στο αίμα.
Γ. 2023-2024
ΕΡΕΥΝΗΤΙΚΕΣ ΧΡΗΜΑΤΟΔΟΤΗΣΕΙΣ στη Τζάρτος ΝευροΔιαγνωστική
Πρόσφατες δημοσιεύσεις της Τζάρτος ΝευροΔιαγνωστική (2019-2024)
1: Gilhus NE, Tzartos S, Evoli A, Palace J, Burns TM, Verschuuren JJGM. Myasthenia gravis. Nature Rev Dis Primers. 2019 May 2;5(1):30. doi: 10.1038/s41572-019-0079-y.
2: Breza M, Smyrni N, Koutsis G, Anagnostou E, Tzartos J, Velonakis G, Kokkinis C, Kilindireas C, Papavasiliou A, Kotsalis C. Ocular flutter as presenting manifestation of pediatric MOG antibody-associated demyelination: A case report. Mult Scler. 2019 Jan;25(1):122-125. doi: 10.1177/1352458518771872
3: Varvaressos S, Breza M, Marousi S, Printzou M, Georgoulis A, Papageorgiou E, Kartanou C, Karadima G, Tagaris G, Koutsis G, Tzartos JS. Complex phenotype in a C9ORF72-positive patient with high-titer anti-glutamic acid decarboxylase antibodies: neuroimmunology meets neurogenetics. Eur J Neurol. 2019 Jul;26(7):e73-e74. doi: 10.1111/ene.13926.
4: Koutsis G, Breza M, Velonakis G, Tzartos J, Kasselimis D, Kartanou C, Karavasilis E, Tzanetakos D, Anagnostouli M, Andreadou E, Evangelopoulos ME, Kilidireas C, Potagas C, Panas M, Karadima G. X linked Charcot-Marie-Tooth disease and multiple sclerosis: emerging evidence for an association. J Neurol Neurosurg Psychiatry. 2019 Feb;90(2):187-194. doi: 10.1136/jnnp-2018-319014.
5: Lazaridis K, Baltatzidou V, Tektonidis N, Tzartos SJ. Antigen-specific immunoadsorption of MuSK autoantibodies as a treatment of MuSK-induced experimental autoimmune myasthenia gravis. J Neuroimmunol. 2020 Feb 15;339:577136. doi:10.1016/j.jneuroim.2019.577136.
6: Breza M, Koutsis G, Tzartos JS, Velonakis G, Evangelopoulos ME, Tzanetakos D, Karagiorgou K, Angelopoulou G, Kasselimis D, Potagas C, Anagnostouli M, Stefanis L, Kilidireas C. MOG antibody-associated demyelinating disease mimicking typical multiple sclerosis: A case for expanding anti-MOG testing? Mult Scler Relat Disord. 2019 Aug;33:67-69. doi:10.1016/j.msard.2019.05.021.
7: Tzartos JS, Karagiorgou K, Tzanetakos D, Breza M, Evangelopoulos ME, Pelidou SH, Bakirtzis C, Nikolaidis I, Koutsis G, Notas K, Chroni E, Markakis I, Grigoriadis NC, Anagnostouli M, Orologas A, Parisis D, Karapanayiotides T, Papadimitriou D, Kostadima V, Elloul J, Xidakis I, Maris T, Zisimopoulou P, Tzartos S, Kilidireas C. Deciphering anti-MOG IgG antibodies: Clinical and radiological spectrum, and comparison of antibody detection assays. J Neurol Sci. 2020 Mar 15;410:116673. doi: 10.1016/j.jns.2020.116673. Epub 2020 Jan 7
8: Lazaridis K, Tzartos SJ. Autoantibody Specificities in Myasthenia Gravis; Implications for Improved Diagnostics and Therapeutics. Front Immunol. 2020 Feb 14;11:212. doi:10.3389/fimmu.2020.00212.
9: Koutsouraki E, Michmizos D, Patsi O, Tzartos J, Spilioti M, Arnaoutoglou M, Tsolaki M. A probable role of copper in the comorbidity in Wilson's and Creutzfeldt-Jakob's Diseases: a case report. Virol J. 2020 Mar 13;17(1):35. doi: 10.1186/s12985-020-01309-x.
10: Tzartos JS, Valsami S, Tzanetakos D, Stergiou C, Dandoulaki M, Barbarousi D, Psimenou E, Velonakis G, Stefanis L, Kilidireas K. Autoimmune hemolytic anemia, demyelinating relapse, and AQP1 antibodies after alemtuzumab infusion. Neurol Neuroimmunol Neuroinflamm. 2020 Apr 2;7(3):e711. doi: 10.1212/NXI.0000000000000711.
11: Papa A, Tzartos JS, Sakoutis G, Dardiotis E, Alexiou E, Breza M, Velonakis G, Papamichalis P, Mpampalis D, Komnos A, Karagiorgou A, Papakonstantinou A, Kilidireas C, Hadjigeorgiou GM. Black holes and high levels of neurofilaments in glial fibrillary acidic protein - astrocytopathy: a case report. Eur J Neurol. 2020 Nov;27(11):2381-2384. doi:10.1111/ene.14244.
12: Yetimler B, Tzartos J, Şengül B, Dursun E, Ulukan Ç, Karagiorgou K, Gezen-Ak D, Sezgin M, Papaconstantinou A, Tzartos S, Orhan EK, Ekizoğlu E, Küçükali Cİ, Baykan B, Tüzün E. Serum glial fibrillary acidic protein (GFAP)-antibody in idiopathic intracranial hypertension. Int J Neurosci. 2021 Aug;131(8):775-779. doi:10.1080/00207454.2020.1758084.
13: Vakrakou A, Constantinides VC, Velonakis G, Tzartos JS, Stefanis L, Kapaki E, Paraskevas GP. Paraneoplastic basal ganglia encephalitis associated with anti-CV2/CRMP-5 and anti-Yo antibodies in a patient with non-small-cell lung cancer. Neurol Sci. 2020 Sep;41(9):2649-2651. doi: 10.1007/s10072-020-04399-1
14: Prevezianou A, Tzartos JS, Dagklis IE, Bentenidi E, Angelopoulos P, Bostantjopoulou S. Paraneoplastic cerebellar degeneration in a patient with breast cancer associated with carbonic anhydrase-related protein VIII autoantibodies. J Neuroimmunol. 2020 Jul 15;344:577242. doi: 10.1016/j.jneuroim.2020.577242.
15: Savaş M, Tzartos J, Küçükali Cİ, Dursun E, Karagiorgou K, Gezen-Ak D, Türkdoğan D, Papaconstantinou A, Başoğlu S, Hacıhafızoğlu N, Kutlubay B, Tzartos S, Tüzün E. Glial fibrillary acidic protein (GFAP)-antibody in children with focal seizures of undetermined cause. Acta Neurol Belg. 2021 Oct;121(5):1275-1280. doi: 10.1007/s13760-020-01361-y.
16: Breza M, Bourinaris T, Efthymiou S, Maroofian R, Athanasiou-Fragkouli A, Tzartos J, Velonakis G, Karavasilis E, Angelopoulou G, Kasselimis D, Potagas C, Stefanis L, Karadima G, Koutsis G, Houlden H. A homozygous GDAP2 loss-of- function variant in a patient with adult-onset cerebellar ataxia. Brain. 2020 Jun 1;143(6):e49. doi: 10.1093/brain/awaa120.
17: Yilmaz V, Ulusoy C, Hajtovic S, Turkoglu R, Kurtuncu M, Tzartos J, Lazaridis K, Tuzun E. Effects of Teriflunomide on B Cell Subsets in MuSK-Induced Experimental Autoimmune Myasthenia Gravis and Multiple Sclerosis. Immunol Invest. 2021 Aug;50(6):671-684. doi:10.1080/08820139.2020.1785491
18: Lazaridis K, Tzartos SJ. Myasthenia Gravis: Autoantibody Specificities and Their Role in MG Management. Front Neurol. 2020 Nov 30;11:596981. doi:10.3389/fneur.2020.596981.
19: Alexandris N, Lagoumintzis G, Chasapis CT, Leonidas DD, Papadopoulos GE, Tzartos SJ, Tsatsakis A, Eliopoulos E, Poulas K, Farsalinos K. Nicotinic cholinergic system and COVID-19: <i>In silico</i> evaluation of nicotinic acetylcholine receptor agonists as potential therapeutic interventions. Toxicol Rep. 2020 Dec 19;8:73-83. doi:10.1016/j.toxrep.2020.12.013.
20: Lagoumintzis G, Chasapis CT, Alexandris N, Kouretas D, Tzartos S, Eliopoulos E, Farsalinos K, Poulas K. Nicotinic cholinergic system and COVID-19: In silico identification of interactions between α7 nicotinic acetylcholine receptor and the cryptic epitopes of SARS-Co-V and SARS-CoV-2 Spike glycoproteins. Food Chem Toxicol. 2021 Mar;149:112009. doi: 10.1016/j.fct.2021.112009.
21: Koneczny I, Yilmaz V, Lazaridis K, Tzartos J, Lenz TL, Tzartos S, Tüzün E, Leypoldt F. Common Denominators in the Immunobiology of IgG4 Autoimmune Diseases: What Do Glomerulonephritis, Pemphigus Vulgaris, Myasthenia Gravis, Thrombotic Thrombocytopenic Purpura and Autoimmune Encephalitis Have in Common? Front Immunol. 2021 Jan 29;11:605214. doi: 10.3389/fimmu.2020.605214.
22: Vakrakou AG, Tzanetakos D, Evangelopoulos ME, Argyrakos T, Tzartos JS, Anagnostouli M, Andreadou E, Koutsis G, Velonakis G, Toulas P, Gialafos E, Dimitrakopoulos A, Psimenou E, Stefanis L, Kilidireas C. Clinico-radiologic features and therapeutic strategies in tumefactive demyelination: a retrospective analysis of 50 consecutive cases. Ther Adv Neurol Disord. 2021 May 18;14:17562864211006503. doi:10.1177/17562864211006503.
23: Topaloudi A, Zagoriti Z, Flint AC, Martinez MB, Yang Z, Tsetsos F, Christou YP, Lagoumintzis G, Yannaki E, Zamba-Papanicolaou E, Tzartos J, Tsekmekidou X, Kotsa K, Maltezos E, Papanas N, Papazoglou D, Passadakis P, Roumeliotis A, Roumeliotis S, Theodoridis M, Thodis E, Panagoutsos S, Yovos J, Stamatoyannopoulos J, Poulas K, Kleopa K, Tzartos S, Georgitsi M, Paschou P. Myasthenia gravis genome-wide association study implicates AGRN as a risk locus. J Med Genet. 2022 Aug;59(8):801-809. doi: 10.1136/jmedgenet-2021-107953.
24: Tzanetakos D, Tzartos JS, Vakrakou AG, Breza M, Velonakis G, Stathopoulos P, Pantou E, Markakis I, Papadimitriou D, Karavasilis E, Toulas P, Evangelopoulos ΜE, Koutsis G, Anagnostouli M, Stefanis L, Kilidireas C. Cortical involvement and leptomeningeal inflammation in myelin oligodendrocyte glycoprotein antibody disease: A three-dimensional fluid-attenuated inversion recovery MRI study. Mult Scler. 2022 Apr;28(5):718-729. doi: 10.1177/13524585211034362
25: Vakrakou AG, Tzanetakos D, Evangelopoulos ME, Fragoulis GE, Kazakou P, Lekka E, Kafasi N, Tzartos JS, Andreadou E, Koutsis G, Gialafos E, Dimitrakopoulos A, Zampeli E, Rontogianni D, Theocharis S, Zapanti E, Stathopoulos PA, Anagnostouli M, Stefanis L, Kilidireas C. IgG4-related autoimmune manifestations in Alemtuzumab-treated multiple sclerosis patients. J Neuroimmunol. 2021 Dec 15;361:577759. doi: 10.1016/j.jneuroim.2021.577759. Epub 2021 Oct 29. PMID: 34742035.
26: Veltsista D, Kefalopoulou Z, Tzartos J, Chroni E. Autoantibody profile in myasthenia gravis patients with a refractory phase. Muscle Nerve. 2022 May;65(5):607-611. doi: 10.1002/mus.27521
27: Karagiorgou K, Dandoulaki M, Mantegazza R, Andreetta F, Furlan R, Lindstrom J, Zisimopoulou P, Chroni E, Kokotis P, Anagnostou E, Tzanetakos D, Breza M, Katsarou Z, Amoiridis G, Mastorodemos V, Bregianni M, Bonakis A, Tsivgoulis G, Voumvourakis K, Tzartos S, Tzartos J. Novel Cell-Based Assay for Alpha-3 Nicotinic Receptor Antibodies Detects Antibodies Exclusively in Autoimmune Autonomic Ganglionopathy. Neurol Neuroimmunol Neuroinflamm. 2022 Mar 29;9(3):e1162. doi: 10.1212/NXI.0000000000001162. Erratum in: Neurol Neuroimmunol Neuroinflamm. 2022 Jul 12;9(5):e1177. doi: 10.1212/NXI.0000000000001177.
28: Koneczny I, Tzartos J, Mané-Damas M, Yilmaz V, Huijbers MG, Lazaridis K, Höftberger R, Tüzün E, Martinez-Martinez P, Tzartos S, Leypoldt F. IgG4 Autoantibodies in Organ-Specific Autoimmunopathies: Reviewing Class Switching, Antibody-Producing Cells, and Specific Immunotherapies. Front Immunol. 2022 Mar 24;13:834342. doi:10.3389/fimmu.2022.834342.
29: McKenzie N, Piconi G, Culeux A, Hammarin AL, Stergiou C, Tzartos S, Versleijen AAM, van de Geer J, Cras P, Cardone F, Ladogana A, Mannana A, Rossi M, Bongianni M, Perra D, Regelsberger G, Klotz S, Hornemann S, Aguzzi A, Schmitz M, Andrews M, Burns K, Haïk S, Ruiz-García R, Verner-Carlsson J, Tzartos J, Verbeek MM, De Vil B, Poleggi A, Parchi P, Zanusso G, Gelpi E, Frontzek K, Reimann R, Hermann P, Zerr I, Pal S, Green A. Concordance of cerebrospinal fluid real-time quaking-induced conversion across the European Creutzfeldt-Jakob Disease Surveillance Network. Eur J Neurol. 2022 Aug;29(8):2431-2438. doi: 10.1111/ene.15387.
30: Lazaridis K, Fernandez-Santoscoy M, Baltatzidou V, Andersson JO, Christison R, Grünberg J, Tzartos S, Löwenadler B, Fribert C. A Recombinant Acetylcholine Receptor α1 Subunit Extracellular Domain Is a Promising New Drug Candidate for Treatment Of Myasthenia Gravis. Front Immunol. 2022 Jun 3;13:809106. doi: 10.3389/fimmu.2022.809106.
31: Vakrakou AG, Tzartos JS, Strataki E, Boufidou F, Dimou E, Pyrgelis ES, Constantinides VC, Paraskevas GP, Kapaki E. Neuronal and Neuroaxonal Damage Cerebrospinal Fluid Biomarkers in Autoimmune Encephalitis Associated or Not with the Presence of Tumor. Biomedicines. 2022 May 28;10(6):1262. doi: 10.3390/biomedicines10061262. PMID: 35740284; PMCID: PMC9220160.
32: Tzartos JS, Boufidou F, Stergiou C, Kuhle J, Willemse E, Palaiodimou L, Tsantzali I, Sideri E, Bonakis A, Giannopoulos S, Voumvourakis KI, Tsivgoulis G, Tzartos SJ, Kapaki E, Paraskevas GP. Plasma P-Tau181 for the Discrimination of Alzheimer's Disease from Other Primary Dementing and/or Movement Disorders. Biomolecules. 2022 Aug 10;12(8):1099. doi: 10.3390/biom12081099.
33: Stergiou C, Williams R, Fleming JR, Zouvelou V, Ninou E, Andreetta F, Rinaldi E, Simoncini O, Mantegazza R, Bogomolovas J, Tzartos J, Labeit S, Mayans O, Tzartos S. Immunological and Structural Characterization of Titin Main Immunogenic Region; I110 Domain Is the Target of Titin Antibodies in Myasthenia Gravis. Biomedicines. 2023 Feb 3;11(2):449. doi:10.3390/biomedicines11020449.
34: Pechlivanidou M, Ninou E, Karagiorgou K, Tsantila A, Mantegazza R, Francesca A, Furlan R, Dudeck L, Steiner J, Tzartos J, Tzartos S. Autoimmunity to neuronal nicotinic acetylcholine receptors. Pharmacol Res. 2023 Jun;192:106790. doi:10.1016/j.phrs.2023.106790.
35: Pafiti A, Krashias G, Tzartos J, Tzartos S, Stergiou C, Gaglia E, Smoleski I, Christodoulou C, Pantzaris M, Lambrianides A. A Comparison of Two Analytical Approaches for the Quantification of Neurofilament Light Chain, a Biomarker of Axonal Damage in Multiple Sclerosis. Int J Mol Sci. 2023 Jun 28;24(13):10787. doi: 10.3390/ijms241310787.
36: Vakrakou AG, Karachaliou E, Chroni E, Zouvelou V, Tzanetakos D, Salakou S, Papadopoulou M, Tzartos S, Voumvourakis K, Kilidireas C, Giannopoulos S, Tsivgoulis G, Tzartos J. Immunotherapies in MuSK-positive Myasthenia Gravis; an IgG4 antibody-mediated disease. Front Immunol. 2023 Jul 26;14:1212757. doi: 10.3389/fimmu.2023.1212757.
37: Pechlivanidou M, Xenou K, Tzanetakos D, Koutsos E, Stergiou C, Andreadou E, Voumvourakis K, Giannopoulos S, Kilidireas C, Tüzün E, Tsivgoulis G, Tzartos S, Tzartos J. Potential Role of Antibodies against Aquaporin-1 in Patients with Central Nervous System Demyelination. Int J Mol Sci. 2023 Aug 19;24(16):12982. doi: 10.3390/ijms241612982.
38: Topaloudi A, Jain P, Martinez MB, Bryant JK, Reynolds G, Zagoriti Z, Lagoumintzis G, Zamba-Papanicolaou E, Tzartos J, Poulas K, Kleopa KA, Tzartos S, Georgitsi M, Drineas P, Paschou P. PheWAS and cross-disorder analysis reveal genetic architecture, pleiotropic loci and phenotypic correlations across 11 autoimmune disorders. Front Immunol. 2023 Sep 21;14:1147573. doi: 10.3389/fimmu.2023.1147573.
39: Tzartos J, Pechlivanidou M, Bosveli D, Ninou E, Yuceer H, Yalcin B, Kucukali CI, Tuzun E, Tzartos S, Turkdogan D. Kelch-like Protein 11 (KLHL11) Antibodies in Children With Seizures of Undetermined Cause. In Vivo. 2024 Jan- Feb;38(1):351-357. doi:10.21873/invivo.13445.
40: Chuquisana O, Stascheit F, Keller CW, Pučić-Baković M, Patenaude AM, Lauc G, Tzartos S, Wiendl H, Willcox N, Meisel A, Lünemann JD. Functional Signature of LRP4 Antibodies in Myasthenia Gravis. Neurol Neuroimmunol Neuroinflamm. 2024 May;11(3):e200220. doi:10.1212/NXI.0000000000200220.
41: Tzartos J, Karagiorgou K, Pechlivanidou M, Tzartos S, Dudeck L, Meyer-Lotz G, Guest PC, Steiner J. Absence of neuronal nicotinic acetylcholine receptor antibodies in sera and CSF from schizophrenia patients. Schizophr Res. 2024 May;267:39-41. doi:10.1016/j.schres.2024.03.019.
42: Koneczny I, Mané-Damas M, Zong S, De Haas S, Huda S, van Kruining D, Damoiseaux J, De Rosa A, Maestri M, Guida M, Molenaar P, Van Damme P, Fichtenbaum A, Perkmann T, De Baets M, Lazaridis K, Zouvelou V, Tzartos S, Ricciardi R, Losen M, Martinez-Martinez P. A retrospective multicenter study on clinical and serological parameters in patients with MuSK myasthenia gravis with and without general immunosuppression. Front Immunol. 2024 Apr 23;15:1325171. doi: 10.3389/fimmu.2024.1325171.
43: Pechlivanidou M, Vakrakou AG, Karagiorgou K, Tüzün E, Karachaliou E, Chroni E, Afrantou T, Grigoriadis N, Argyropoulou C, Paschalidis N, Şanlı E, Tsantila A, Dandoulaki M, Ninou EI, Zisimopoulou P, Mantegazza R, Andreetta F, Dudeck L, Steiner J, Lindstrom JM, Tzanetakos D, Voumvourakis K, Giannopoulos S, Tsivgoulis G, Tzartos SJ, Tzartos J. Neuronal nicotinic acetylcholine receptor antibodies in autoimmune central nervous system disorders. Front Immunol. 2024 May 28;15:1388998. doi: 10.3389/fimmu.2024.1388998.

- Δημοσίευση στο Αθηναϊκό Πρακτορείο Ειδήσεων: Διάγνωση της ν. Αλτσχάιμερ με απλή εξέταση αίματος (p-Tau217) 08-01-2025
- Μέτρηση στο αίμα του νέου βιοδείκτη pTau217 για τη διάγνωση της νόσου Alzheimer (με SIMOA) 19-10-2023
- Νέος βιοδείκτης του αίματος (GFAP) για ΣκΠ, NMO, Alzheimer και τραυματική εγκεφαλική βλάβη (με SIMOA) 21-04-2023
- «Ανοιχτές πόρτες» για νευρολόγους στην Τζάρτος ΝευροΔιαγνωστική 16-01-2023
- “Consensus Statement” για την μέτρηση των NfL στο αίμα, στην έρευνα και κλινική πράξη για την ΣκΠ 22-11-2022
- Ανάπτυξη μιας πολύ ειδικής διάγνωσης για την αυτοάνοση αυτόνομη γαγγλιονοπάθεια 02-05-2022
- Νέες εξετάσεις για δυσαυτονομία (α3), εγκεφαλίτιδες (Kelch), νευροπάθειες, μυασθένεια (αγρίνη) κ.α. 02-05-2022
- Μέτρηση βιοδεικτών της Alzheimer στο αίμα με την πρωτοποριακή τεχνολογία SIMOA, στο εργαστήριο μας 04-01-2022
- ΔΡΑΣΗ ΕΘΝΙΚΗΣ ΕΜΒΕΛΕΙΑΣ: «ΕΡΕΥΝΩ-ΔΗΜΙΟΥΡΓΩ-ΚΑΙΝΟΤΟΜΩ» 14-12-2021
- Το προσωπικό μας έχει εμβολιαστεί κατά της covid-19. 24-05-2021
 English
English  Greek
Greek